휴머니젠, 2021년 2분기 재무 결과 보고
휴머니젠의 2020년과 2021년 6월 30일을 종료 일자로 하는 3개월 및 6개월간 주요 재무 상황 개요
벌링게임, 캘리포니아--(뉴스와이어)--주요 치료제 후보 물질인 렌질루맙(Lenzilumab)을 보유하고 있으며 ‘사이토카인 폭풍’이라고 불리는 면역 과잉 반응을 예방 및 치료하는 데 중점을 두는 임상 단계 바이오 제약사인 휴머니젠(Humanigen, Inc., Nasdaq: HGEN)은 기업 및 규제 관련 업데이트 사항을 18일 공개했으며, 2분기 및 2021년 6월 30일 종료 6개월간의 재무 결과를 발표했다.
◇긴급사용승인(Emergency Use Authorization, EUA) 신청 관련 업데이트 사항
2021년 5월 28일 휴머니젠은 코로나 입원 환자에게 렌질루맙 치료제를 사용할 수 있도록 긴급사용승인 신청서를 제출했다. 신청 이후 휴머니젠은 이번 신청과 관련해 몇 차례에 걸친 미국 식품의약국(FDA)의 요청에 대응해왔다. FDA에서는 휴머니젠의 긴급사용승인 신청에 대한 검토를 위한 공식적인 타임라인을 갖고 있지 않기 때문에 휴머니젠으로서는 FDA의 결정 시기에 대한 지침을 제공할 수 없는 상황이다.
휴머니젠 최고경영자(CEO) 카메론 듀란(Cameron Durrant) 박사는 “우리는 라이브에어(LIVE-AIR) 임상 3상 연구 결과가 렌질루맙 치료제의 긴급사용승인을 획득할 수 있도록 보장할 것임을 굳건히 믿고 있다. 전체 환자군을 대상으로 1차 목표를 달성했다는 사실과 연구에 참여한 흑인 및 아프리카계 미국인 환자군의 치료에서 상당한 반응을 보인 최근의 추가적 부분 집합 분석 결과를 보면 렌질루맙 사용이 승인됐을 때 환자 치료에 잠재적 이익을 가져올 것이라는 우리의 견해가 타당함을 알 수 있다”고 말했다.
티모시 모리스(Timothy E. Morris) 휴머니젠 COO 겸 CFO는 “긴급사용승인 신청에 대한 검토가 이어지고 있는 동안 우리는 앞으로 예상되는 미국에서의 약품 출시를 준비하고 있으며, 이와 함께 2021년 3분기 말 전까지 영국 의약품규제청(MHRA)에 신약 허가신청(Marketing Authorization Application, MAA) 제출을 완료하기 위해 노력하고 있다”고 말했다. 그는 “우리는 유럽의약품청(European Medicines Agency, EMA)을 상대로 하는 신약 허가신청 과정에 착수하기 시작했으며 머지않아 심사관이 지정될 것으로 기대하고 있다”고 덧붙였다.
◇2분기 및 최근 부각된 특징
· 코로나19 입원 환자를 대상으로 한 렌질루맙 치료제
- 코로나19 감염병 입원 환자의 치료제로 렌질루맙을 사용할 수 있도록 미국 FDA에 긴급사용승인 신청
- 신청서 제출 및 코로나19 치료를 위한 렌질루맙의 영국 내 신약 허가 신청이 영국 의약품규제청의 신속한 사전 검토를 위해 접수됐다는 사실을 고지받음. 제출은 2021년 9월 30일까지 완료될 것으로 예상
- 유럽의약품청을 대상으로 한 코로나19 치료제 렌질루맙의 신약 허가 신청 제출 과정 시작
- 한국과 필리핀에 있는 휴머니젠의 사업 파트너인 케이피엠테크(KPM Tech), 텔콘RF제약(Telcon RF Pharmaceutical)은 앞으로 한국에서의 신청서 제출 및 잠정적인 승인을 받을 수 있도록 한국 식품의약품안전처에서 렌질루맙 임상 1상 시험 계획을 승인받음
- 코로나19 입원 환자를 대상으로 한 렌질루맙의 라이브에어 임상 3상 분석 결과 CRP 수치가 150mg/L 미만인 흑인 입원 환자들이 호흡기 없이 생존할 확률(suvival without ventilation, 이하 SWOV)에서 약 9배 높은 수치를 보여 렌질루맙 치료제의 최대 반응군이 될 수 있다는 내용을 발표.[n=51, p-value=0.0418] 라이브에어 임상 3상 결과, CRP 수치가 150mg/L 미만을 보이는 전체 대상 중에서 렌질루맙 치료제를 처방받은 환자들이 2.5배 높은 SWOV 수치를 보임.[mITT, n=351, p-value=0.0009]
- 미국 외 지역에서 필요한 규제 승인을 획득해 렌질루맙 벌크 약제 및 판매용 약품을 생산하는 것을 골자로 한 위탁생산계약을 차임 바이오로직스(Chime Biologics)사와 체결
· 법인
- 보통주에 대한 인수 공모를 완료해 총 9420만달러의 순 조달액을 달성
- 2021년 6월 러셀3000지수(Russell 3000®)에 편입됨.
- 신설된 투자자 관리(IR) 부문 상무직에 켄 트르보비쉬(Ken Trbovich) 임명.
◇ACTIV-5 업데이트 사항
2021년 8월, 미국 국립보건원(National Institutes of Health; NIH)은 ACTV-5/BET-B로 불리는 코로나19 치료 중재 및 백신 가속화(Accelerating COVID-19 Therapeutic Interventions and Vaccines; ACTIV-5)및 Big Effect Trial B군(BET-B) 프로그램을 확대할 계획이라고 발표했다. 휴머니젠으로부터 피드백을 받으며 논의를 이어가는 미국 국립보건원은 최소 400명의 환자 등록을 목표로 한 연구를 임상 2/3상 단계까지 진행했으며, 휴머니젠의 라이브에어(LIVE-AIR) 실험 설계에 맞춰 ACTIV-5/BET-B 프로토콜을 수정했다. 임상 2/3상까지의 진행 및 프로토콜 수정 결과 휴머니젠은 향후 ACTIV-5/BET-B 데이터가 코로나19 환자군에 대한 렌질루맙의 효과를 증명할 경우 ACTIV-5/BET-B가 생물의약품 품목 허가(Biologics License Application; BLA)의 하나로 FDA에 제출해야 하는 2차 확인 연구의 역할을 할 수 있을 것으로 내다봤다.
◇2분기 및 2021년 6월 30일 종료 6개월간 재무 성과
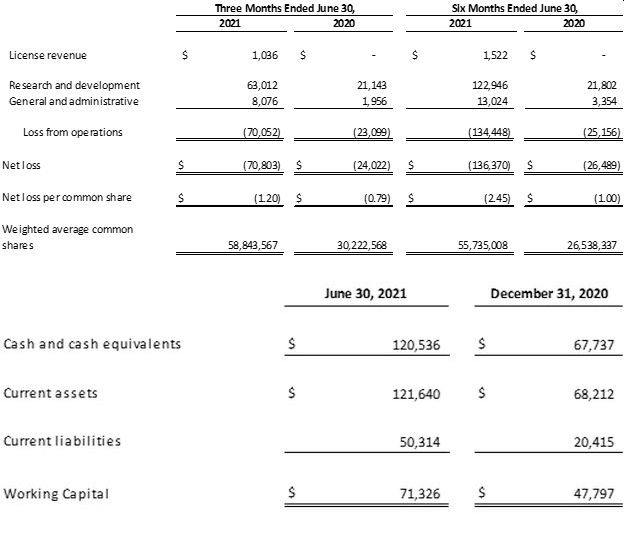
2021년 6월 30일을 종료 일자로 하는 3개월간의 순손실은 7080만달러였으며 주당 가격은 1.20달러로 2020년 6월 30일을 종료 일자로 하는 3개월간 순손실 2400만달러 및 주당 가격 0.79달러와 대비된다. 2021년 6월 30일을 종료 일자로 하는 6개월간의 순손실은 1364만달러에 주당 가격은 2.45달러로, 2020년 6월 30일을 종료 일자로 하는 6개월간의 순손실 2650만달러 내지 주당 가격 1달러와 대비된다. 두 기간 순손실 증가는 주로 총비용 증가에 따른 것으로, 총비용 증가의 주요 원인은 연구 개발 비용이며 규제 승인에 따른 잠재적 상업화에 대비해 렌질루맙의 생산 노력을 가속하면서 큰 폭으로 상승했기 때문이다. 연구 개발 비용은 2020년 6월 30일을 종료 일자로 하는 3개월 기간의 2110만달러에서 4190만달러 증가해 2021년 6월 30일을 종료 일자로 하는 3개월간 6300만달러를 기록했으며 2020년 6월 30일을 종료 일자로 하는 6개월 기간에 기록한 2180만달러에서 1억110만달러 증가해 2021년 6월 30일을 종료 일자로 하는 6개월 기간에는 1억2290만달러에 달했다. 연구 개발에 포함된 제조 경비는 지난해 같은 기간 1710만달러였던 것과 비교해 2021년 2분기에는 5710만달러였으며 2021년 6월 30일을 종료 일자로 하는 6개월 기간에는 지난해 같은 기간 1740만달러 대비 1억710만달러를 기록했다. 렌질루맙 생산에 따라 발생하는 비용은 생산 비용이 재고로 재분류되는 시점인 렌질루맙의 상용화 승인 혹은 인가 시점 전까지 연구 개발 비용에 포함될 예정이다. 이런 비용의 상당 부분은 현장별 제조 공정 개시와 연관된다.
◇현금 및 현금 등가물
2021년 6월 30일을 종료 일자로 하는 6개월간의 영업 활동에 사용된 순 현금, 즉 대차대조표상 순 변동 금액은 1억380만달러였다. 같은 기간 휴머니젠은 시장가 매각(At-the-Market offering)에 따른 보통주 지분 판매로 3610만달러의 순수익을 올렸으며, 허큘리스 캐피털(Hercules Capital)과의 신용 거래를 통해 순수익 2440달러를 제공하는 첫 분할 차입 2500만달러를 유치했고 보통주 공모를 통해 순수익 9420달러를 기록했다. 2021년 6월 30일을 기준으로 자사는 총 1억2050만달러에 해당하는 현금 및 현금 등가물을 보유하고 있다. 자사는 추후 미국의 긴급사용승인이나 영국의 조건부 신약 판매 허가에 따른 잠재적인 렌질루맙 상용화를 예상해 렌질루맙 생산에 꾸준히 자금을 투입할 계획이다. 자사는 2021년 3분기의 렌질루맙 생산과 관련된 연구 개발비가 2021년 2분기와 동일한 수준을 기록할 것으로 예상한다. 만일 2021년 3분기에 렌질루맙의 미국 긴급사용승인이나 영국 조건부 신약 판매 허가가 이뤄지지 않는다면 휴머니젠은 렌질루맙 생산에 투입되는 지출을 축소할 계획이다.
2020년과 2021년 6월 30일을 종료 일자로 하는 3개월 및 6개월간 주요 재무 상황 개요는 이미지를 참조하면 된다.(단위: 1000달러)
휴머니젠(Humanigen, Inc.) 개요
임상 단계 바이오 제약사인 휴머니젠(Humanigen, Inc., Nasdaq: HGEN)은 사이토카인 폭풍(cytokine storm)이라고 불리는 면역 과민 반응을 예방하고 치료하는 데 주력하고 있다. 렌질루맙(Lenzilumab)은 과립구 대식세포 증식인자(GM-CSF)와 결합해 이를 중화시키는 혁신 신약 항체다. 임상 전 모형 결과에 따르면 GM-CSF는 사이토카인 폭풍과 관련된 다수의 염증성 사이토카인과 케모카인의 상위 조절인자라는 사실을 알 수 있다. 코로나19 유행 초기에 이뤄진 연구에서는 T 세포를 분비하는 GM-CSF의 높은 수치가 발병도 및 중환자실(ICU) 입원과 상관관계가 있다는 결론이 나왔다. 휴머니젠의 라이브에어(LIVE-AIR) 임상 3상 시험 결과, 렌질루맙을 조기에 투여받은 코로나19 입원 환자는 본격적인 사이토카인 폭풍을 피할 수 있는 것으로 나타났다. 휴머니젠은 CD19를 표적으로 하는 CAR-T 세포 치료법과 연관된 사이토카인 폭풍의 치료제로서 렌질루맙을 개발 중이며 알레르기성 조혈줄기세포이식(HSCT) 수술을 받은 환자들에게서 발생하는 급성 대숙주성 이식편명(GvHD)과 호산성 천식, 류머티즘 관절염 등의 기타 염증성 질환에도 렌질루맙이 효과를 보일지 연구하고 있다. 휴머니젠은 또 염증 치료제와 면역 항암제를 대상으로 하는 임상 및 전임상 치료법도 개발하고 있다. 더 자세한 정보는 웹사이트에서 확인할 수 있다. 휴머니젠 링크트인과 트위터, 페이스북을 통해서도 자세한 정보를 확인할 수 있다.
미래예측진술
이 보도자료에 포함된 모든 진술은 역사적 사실을 제외하고는 모두 미래예측진술에 해당한다. 미래예측진술은 미래 성과 혹은 사건에 대한 경영진의 현재 지식과 가정, 판단, 기대를 반영한다. 경영진은 그런 진술에 담긴 기대가 합리적인 것이라고 생각하지만, 그런 기대가 현실로 실현된다는 보장은 없으므로 실제 상황이나 결과는 이들 미래예측진술에 들어 있는 내용과 크게 다를 수 있다는 점을 명심해야 한다. ‘될 것이다’와 ‘기대된다’, ‘의도한다’, ‘계획하다’, ‘잠재적인’, ‘가능성 있는’, ‘목표’, ‘가속하다’, ‘이어가다’ 이 외 유사한 표현으로 미래상황예측보고서가 구성되며 이 보고서에는 다음의 내용이 포함된다: 코로나19 환자에게 렌질루맙을 적용해 얻을 것으로 예상되는 잠재적 효과에 대한 휴머니젠의 신뢰, 영국 및 유럽에서의 신약 허가신청 신청서 제출 시기, 휴머니젠이 긴급사용승인 혹은 미국 이외 국가에서의 판매 승인을 받을 것이라는 잠재성으로 아직은 확정적으로 이야기하지 못하는 사항, 추후 미국에서의 생물의약품 품목 허가를 뒷받침하거나 기타 규제 신청을 증진할 수 있도록 ACTIV-5/BET-B가 확정적 연구의 역할을 할 잠재성, 긴급사용승인 혹은 기타 판매 승인이 주어졌을 때 미국 및 기타 시장에서의 렌질루맙 상용화에 대비한 자사의 기대 지출, 휴머니젠의 현재 파이프라인 기술과 관련된 휴머니젠의 가치관에 대한 언급.
미래상황예측보고서는 다음과 같은 다수의 리스크 및 불확실성을 수반한다: 수익성 및 잠재적 사업 성장에 필요한 추가 자본의 부족에서 기인하는 리스크, 긴급사용 승인 혹은 기타 조건부 판매 승인이 주어질 경우 그에 따른 렌질루맙의 상용화를 성공적으로 진행할 수 있는 자사 역량, 후보 제품군의 개발 진행에 따른 협력사에 대한 의존도, 개발 및 필수 규제 승인 획득 및 신규 바이오의약품 출시로 파생되는 불확실성, 계류 중인 혹은 미래의 소송에 따른 결과, SEC에 자사가 제출한 휴머니젠 정기 및 기타 신고 내용 내 "‘험 요소(Risk Factors)’에 서술된 다수의 리스크 및 불확실성.
모든 미래예측진술은 이 경고 언급을 통해 일체의 보장이 주어지지 않는다는 사실이 분명히 드러나 있다. 미래 사건을 예측하는 데 미래예측진술에 의존해서는 안 된다. 각 상황에서 별도로 법에 따라 요구되지 않는 한 자사는 미래예측진술에 담긴 내용이 현시점 이후의 사건 혹은 상황을 반영하도록, 신규 정보 혹은 예측하지 못한 상황의 발생을 반영하도록, 실제 벌어진 상황이 미래예측진술의 예측과 다른 이유를 반영하도록 별도의 개정이나 내용 추가를 해야 할 의무를 지지 않는다.